作者:中科睿极
浏览量:1500

2025-06-25
分享

2025年5月26日,广州医科大学附属第三医院张智勇教授团队在国际著名生物材料研究学术刊期刊《Biomaterials Research》(IF:9.6)发表题为“Automated and Enclosed Three-Dimensional Biofabrication System for Mesenchymal Stem Cell Culture to Enhance Diabetic Wound Healing(基于3D微载体-生物反应器系统增强hUCMSCs对糖尿病创面愈合的治疗效果)”的研究论文,根据该研究成果,三维培养更能生产足够的高质量间充质干细胞以满足临床需求。
《Biomaterials Research》是一本由美国科学促进会(AAAS)出版的医学国际刊物(原出版商为Springer Nature),国际简称为BIOMATER RES,中文名称生物材料研究。该刊创刊于1997年,出版周期为Continuous publication。《Biomaterials Research》2025年影响因子9.6,5年平均影响因子12.5,被收录于国际知名权威数据库SCIE。
随着社会老龄化的进展,糖尿病在世界范围内的发病率显著增高,糖尿病所致的慢性不愈合创面等并发症严重影响患者的健康和生活质量,是一个重大的临床挑战。人脐带间充质干细胞(human umbilical cord mesenchymal stem cells, hUCMSCs)因具有调节炎症反应、分泌生长因子以及增强血管形成等优势,在创面修复的治疗中展现出巨大优势。目前,临床试验中使用的UCMSC大部分是通过传统的二维(Two-Dimensional, 2D)培养系统生产的。尽管2D培养生产方法满足早期临床试验的要求,但细胞产量不足以满足商业治疗应用,且重复传代会诱导细胞衰老,从而损害细胞的治疗特性。因此,迫切需要开发替代培养方法来生产足够的高质量间充质干细胞以满足临床需求。三维(Three-Dimensional, 3D)培养可应对这一挑战,并可作为更接近体内生理条件的模型。
在该项研究中,基于三维微载体-生物反应器系统扩增培养hUCMSCs,对其生物学特性以及糖尿病创面修复的潜在治疗作用进行了全面研究。研究表明,从这种3D微载体-生物反应器系统收获的hUCMSCs符合质量标准,遗传稳定并保持了干性的同时,具有更强的生物效力。与在2D条件下扩增的hUCMSCs相比,3D培养的hUCMSCs通过炎症调节作用,促进血管化,从而加速糖尿病小鼠皮肤伤口的愈合过程。总的来说,该研究结果揭示3D微载体-生物反应器系统有希望作为一种策略,提供可规模生产且具有安全性、稳定性和有效性的hUC-MSCs,为hUC-MSCs治疗糖尿病创面提供新的见解。
研究结果
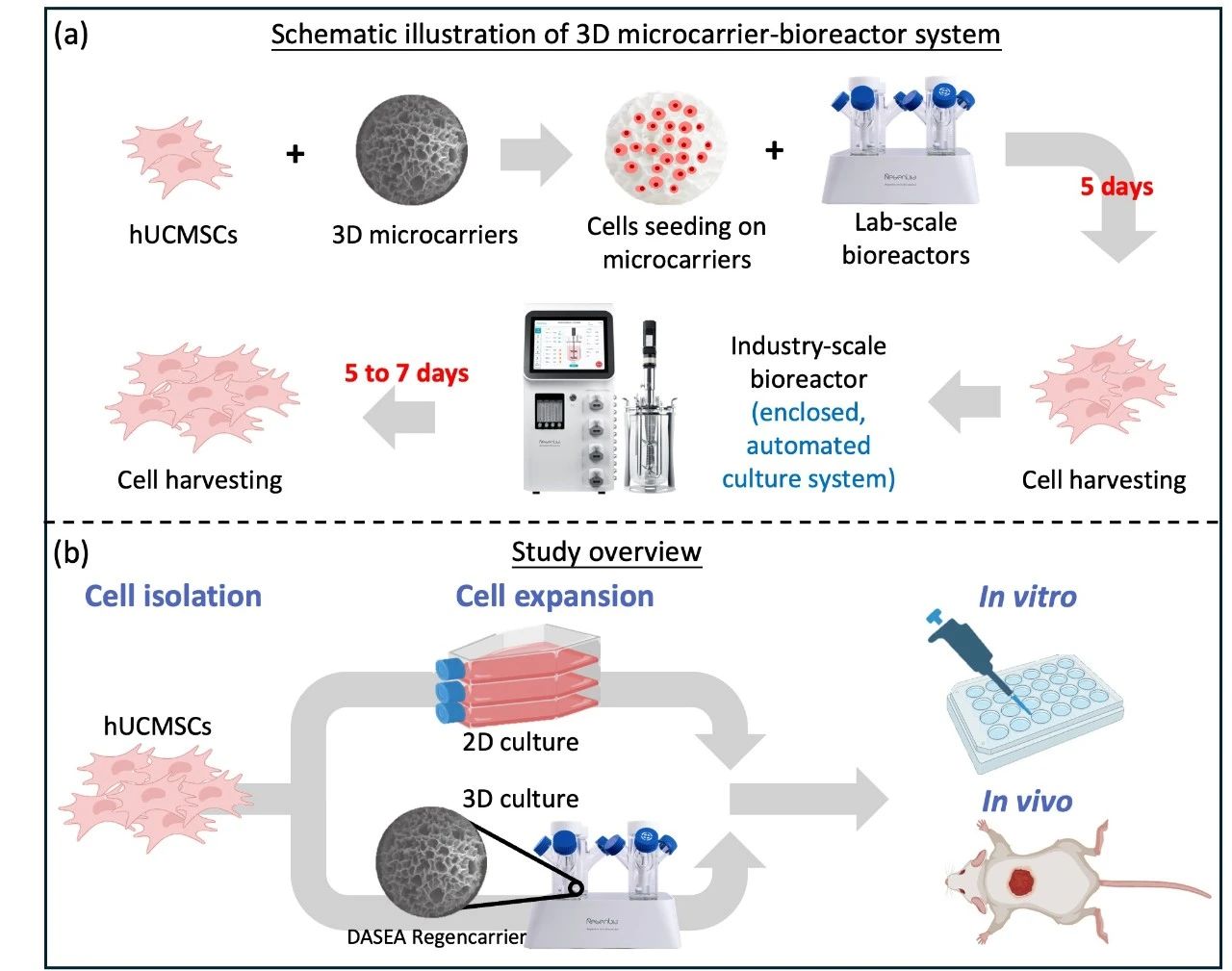
取自原文:Fig 1
研究团队通过中科睿极(海宁)生物科技有限公司DASEA® 数字化(Digitalized)、自动化(Automated)、规模化(Scalable)、封闭化(Enclosed)、活性化(Activated)3D智能平台,采用非动物源性重组胶原微载体(CDE:F20230000567;FDA:MF 30042/MF 039036):微载体的孔隙率>90%,粒径大小可控于150-400μm之间,结合DASEA® Regenbio 全自动3D细胞培养系统,为MSCs提供了更加接近体内环境的生长条件,实现了干细胞规模化的三维培养扩增(安全性、稳定性和有效性)。
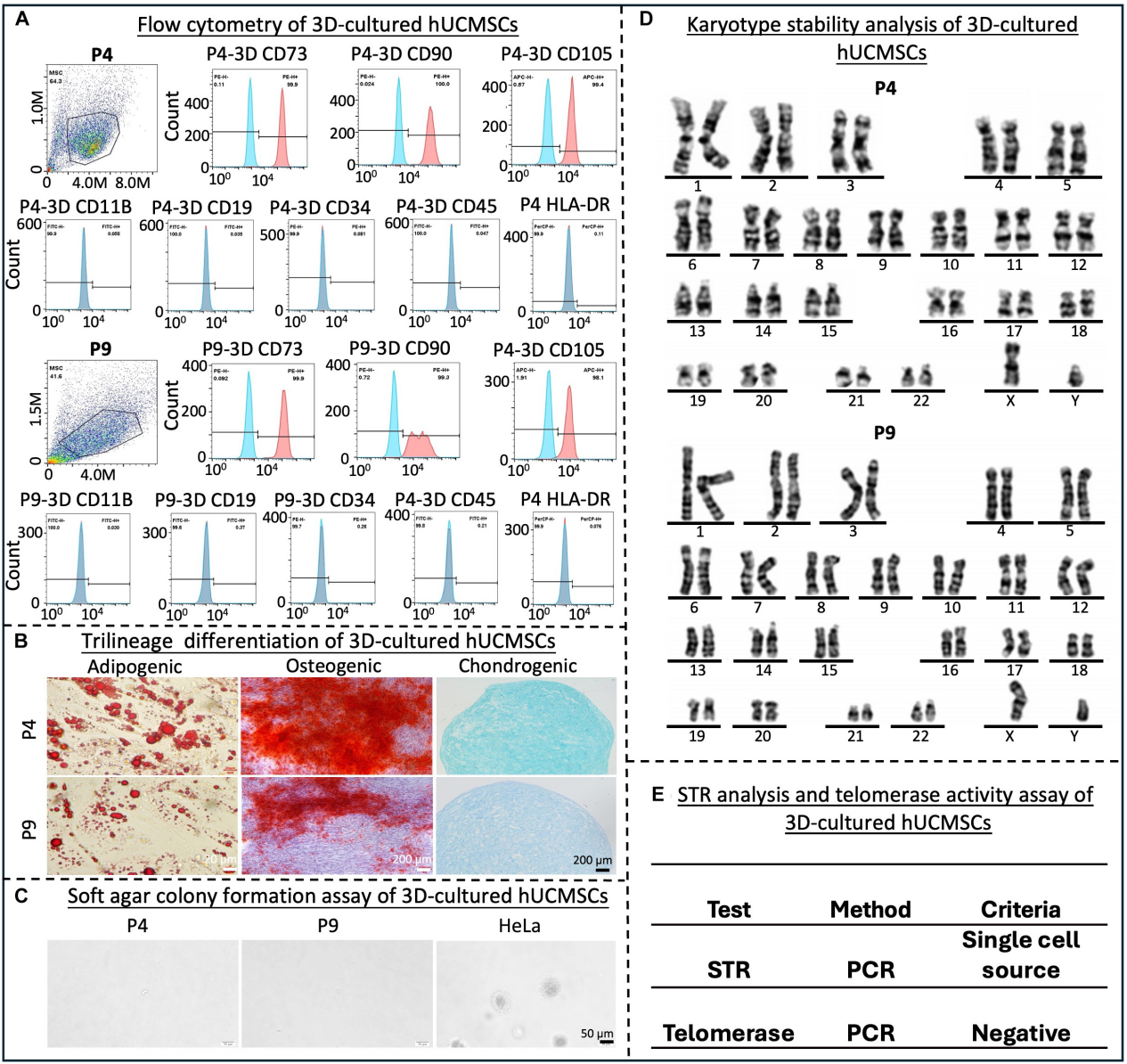
取自原文:Fig 2
首先,对收获的3D-MSCs进行了系列细胞质量研究检测。结果证实,3D扩增 P4、P9的MSC均保留了表型表面标志物,阳性和阴性标志物的表达率分别 >95% 和 <2%(Fig 2.A),符合国际细胞治疗协会 (ISCT) 设定的标准,且细胞保持了分化为脂肪生成、成骨和软骨生成谱系的能力(Fig 2.B)。此外,hUCMSCs还接受了生物安全性测试。G显带染色体核型分析证实了3D扩展细胞的基因组稳定性(Fig 2.D),而软琼脂克隆形成试验和端粒酶活性试验表明细胞不具有致瘤性(Fig 2.C,E)。STR分析进一步证明hUCMSCs没有被其他细胞系污染(Fig 2. E)。以上结果表明,通过自主3D培养扩增的hUCMSCs满足干细胞治疗的必要质量要求。
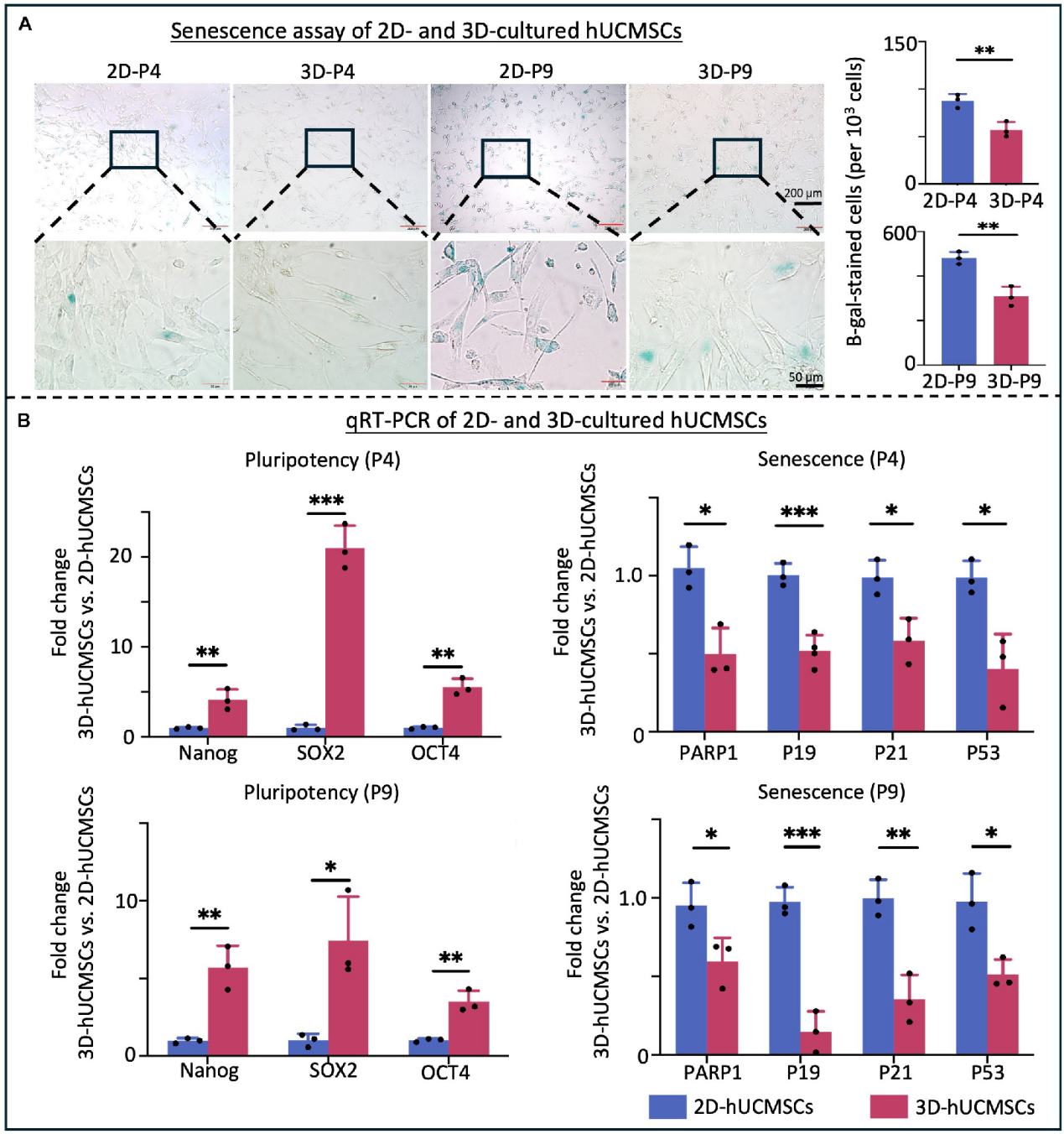
取自原文:Fig 3
长期细胞培养会导致细胞衰老。通过SA-β-gal细胞染色和qRT-PCR检测衰老基因,比较2D和3D培养的hUCMSCs衰老情况。SA-β-gal染色显示,3D培养细胞的衰老细胞数量显著减少(Fig 3.A)。与染色结果一致,与2D hUCMSCs相比,3D hUCMSCs中衰老相关分泌表型(SASP)(PARP1、P19、P21和P53)的基因表达水平显著降低。同时,多能性相关转录因子(OCT4、SOX2、NANOG)基因表达水平显著升高。以上结果进一步证明,3D培养减缓了hUCMSCs的衰老并保持了干性(Fig 3.B)。
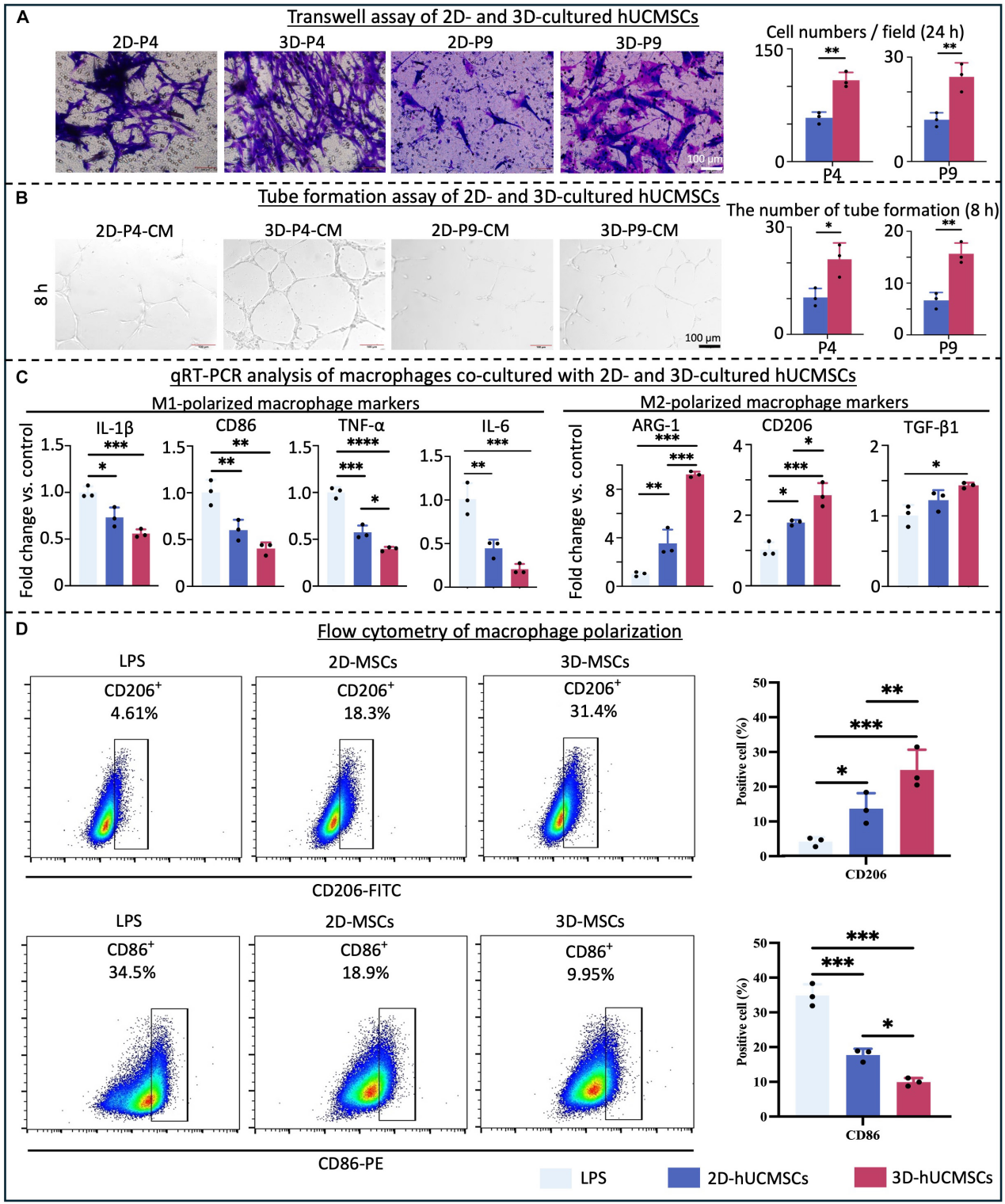
取自原文:Fig 4
Transwell迁移实验分析显示,与2D培养的hUCMSCs相比,3D培养的hUCMSCs的细胞迁移能力更高(Fig 4.A)。体外matrigel成管形成试验显示,与2D-CM组相比,3D-CM处理组HUVECs内皮细胞的血管形成数量增加(Fig 4.B)。qRT-PCR分析表明,与2D-hUCMSCs共培养的巨噬细胞相比,与3D-hUCMSCs共培养的巨噬细胞中与M1极化相关的基因(CD 86、TNF-a、IL-1 β)的表达水平较低,与M2极化相关的基因(ARG-1、CD 206)的表达水平较高(Fig 4.C)。同时,流式细胞术结果显示,3D-hUCMSCs促进了巨噬细胞向M2表型的转化(Fig 4.D)。以上结果证明,3D培养的hUCMSCs具有更强的血管生成和抗炎能力。
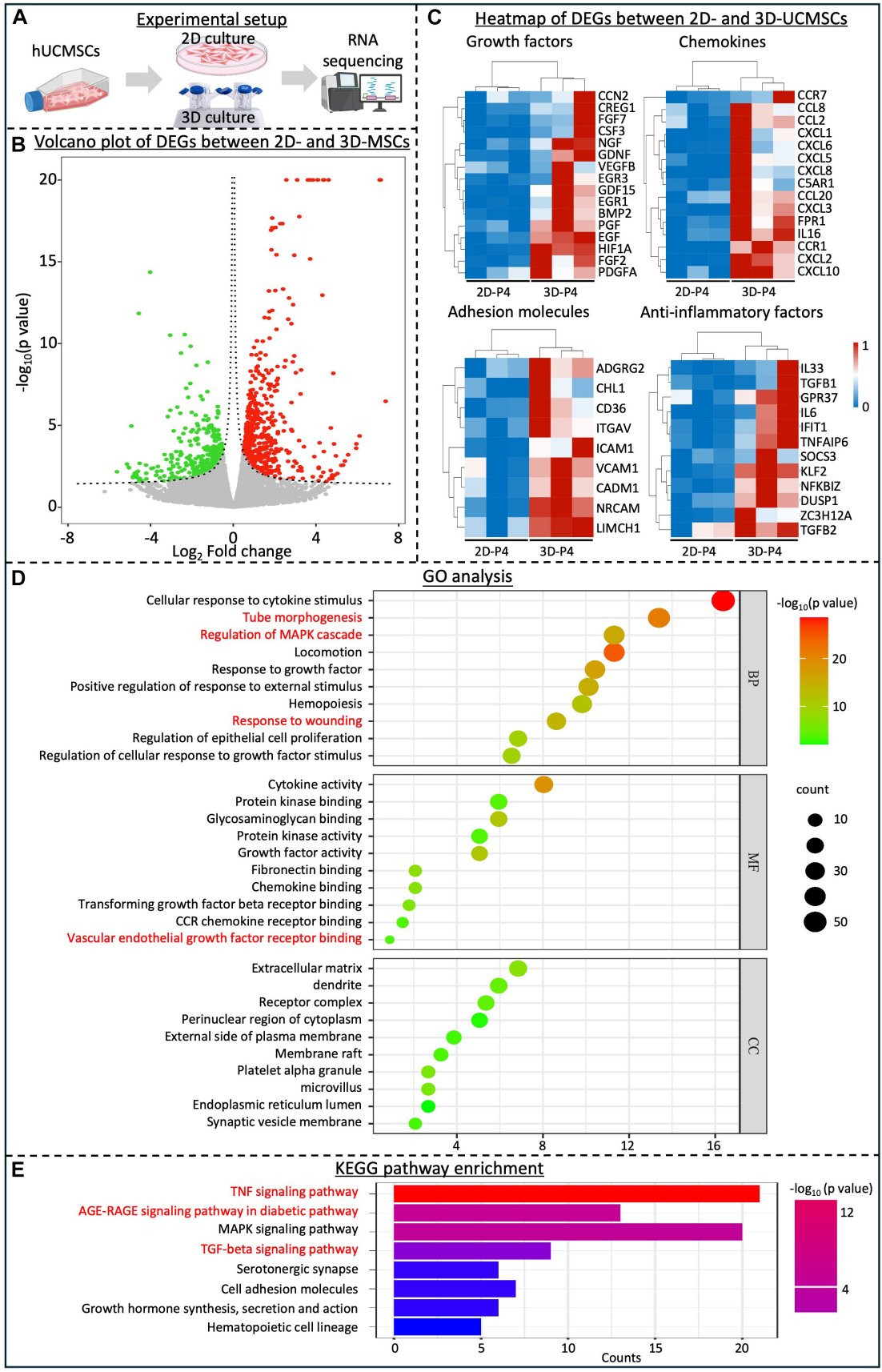
取自原文:Fig 5
为了进一步比较2D和3D培养的hUCMSCs之间的基因表达谱和信号通路的激活情况,分别收获P4代次细胞进行了RNA-seq(Fig 5.A)。火山图和热图揭示了2D和3D-UCMSCs的差异表达基因(Fig 5.B-C)。与2D-UCMSCs相比,3D-UCMSCs表现出多种生长因子、粘附分子、趋化因子和抗炎因子的显著上调(Fig 5.C)。GO分析表明,大多数差异基因与血管生成、细胞增殖、蛋白质同工酶活性和细胞因子活性正相关(Fig 5.D),KEGG途径分析表明差异表达基因(DEG)参与多种信号途径,例如晚期糖基化终产物-晚期糖基化终产物受体(AGE-RAGE)信号途径(糖尿病相关)、肿瘤坏死因子信号途径和转化生长因子-β信号途径(Fig 5.E)
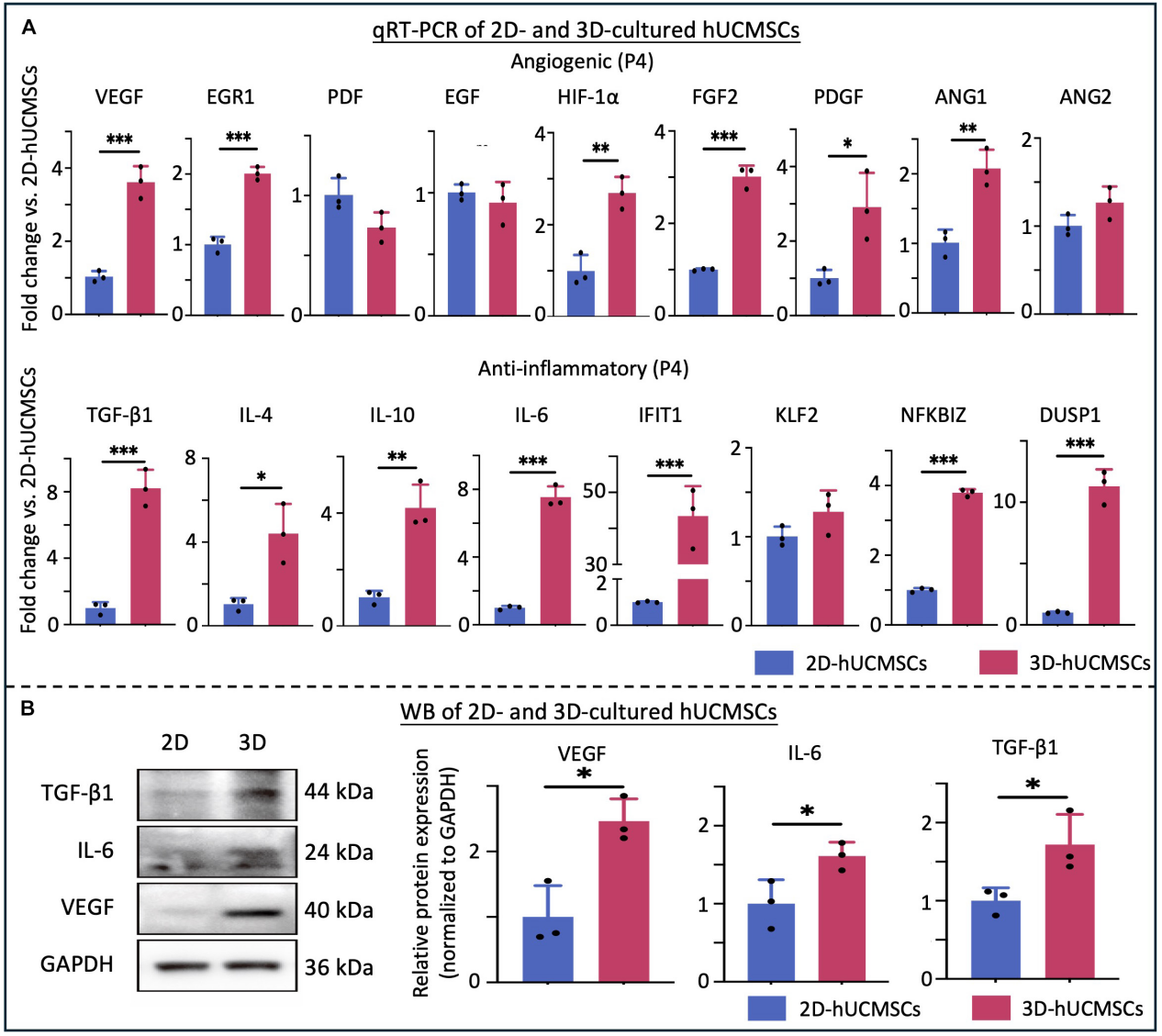
取自原文:Fig 6
为了进一步验证RN-seq结果并探索在2D和3D环境下培养的hUCMSCs中血管生成和抗炎细胞因子和生长因子的表达,进行了qRT-PCR和WB。qRT-PCR结果表明,3D培养的hUCMSCs中血管生成和抗炎基因的表达显着更高(Fig 6.A)。WB分析显示,与2D培养的hUCMSCs相比,3D培养的hUCMSCs中VEGF、TGF-β1和IL-6的蛋白水平增加(Fig 6.B)。这些发现表明,3D培养物可能通过促进血管生成和抗炎作用来增强hUCMSCs的治疗效力。
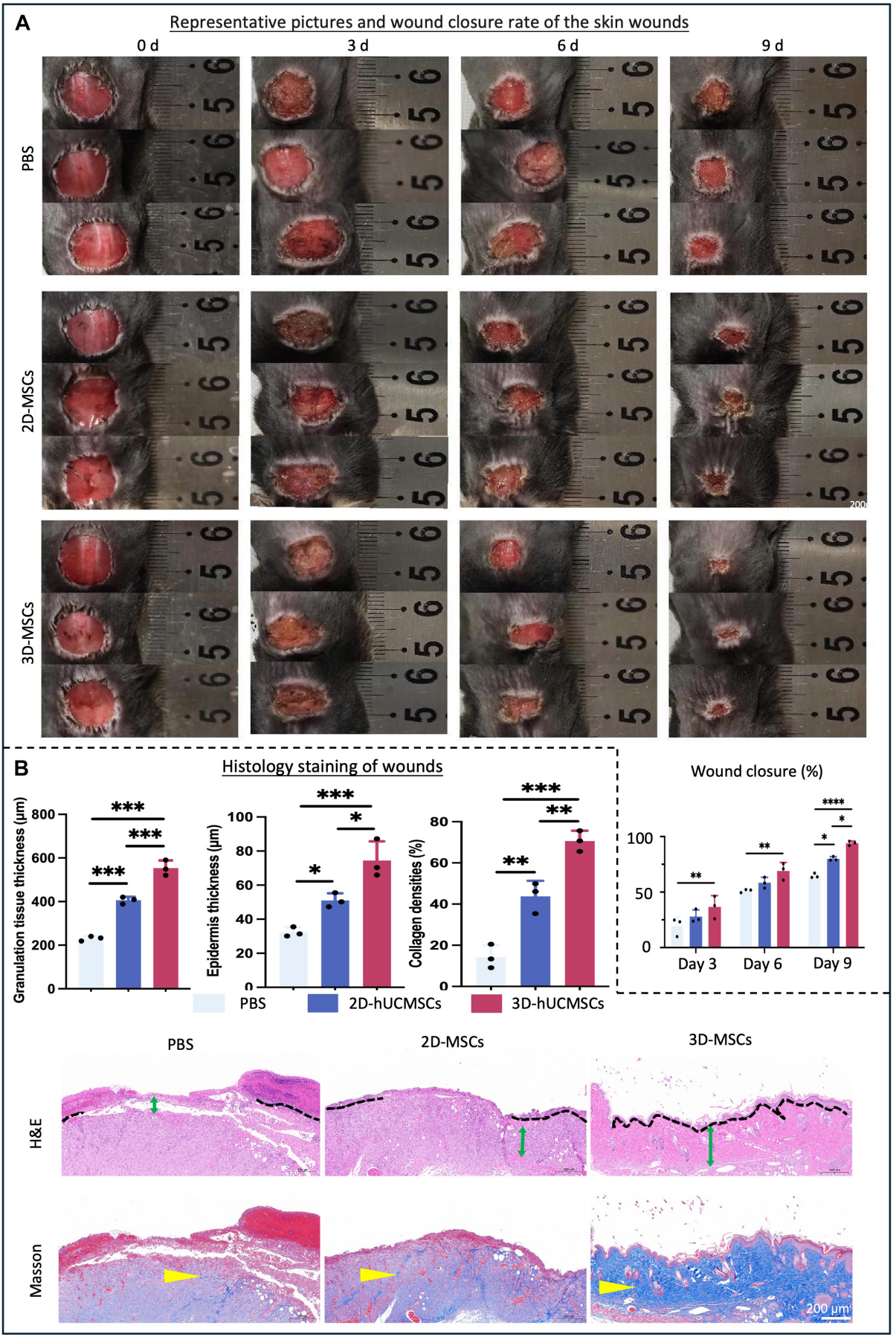
取自原文:Fig 7
建立糖尿病小鼠全层皮肤创面模型,以研究hUCMSCs对糖尿病伤口愈合的治疗作用。链脲佐菌素(STZ; 125 mg/kg)刺激一周后进行皮肤缺损模型研究,随机分组分别在创面区域周围皮下注射1×106 2D hUCMSCs、1×106 3D hUCMSCs以及等剂量PBS。与2D-hUCMSCs相比,3D-hUCMSCs治疗后第3、6和9天的伤口愈合更快(Fig 7.A)。HE染色和半定量分析显示,与2D-hUCMSCs和PBS组相比,3D-hUCMSCs组创面皮肤区域的表皮更厚,创面的上皮化更明显。Masson的三色染色和半定量分析显示,与2D-hUCMSCs组相比,3D-hUCMSCs组中的蓝色胶原沉积更多。结果证明,3D-MSCs能够加速糖尿病小鼠皮肤伤口愈合。
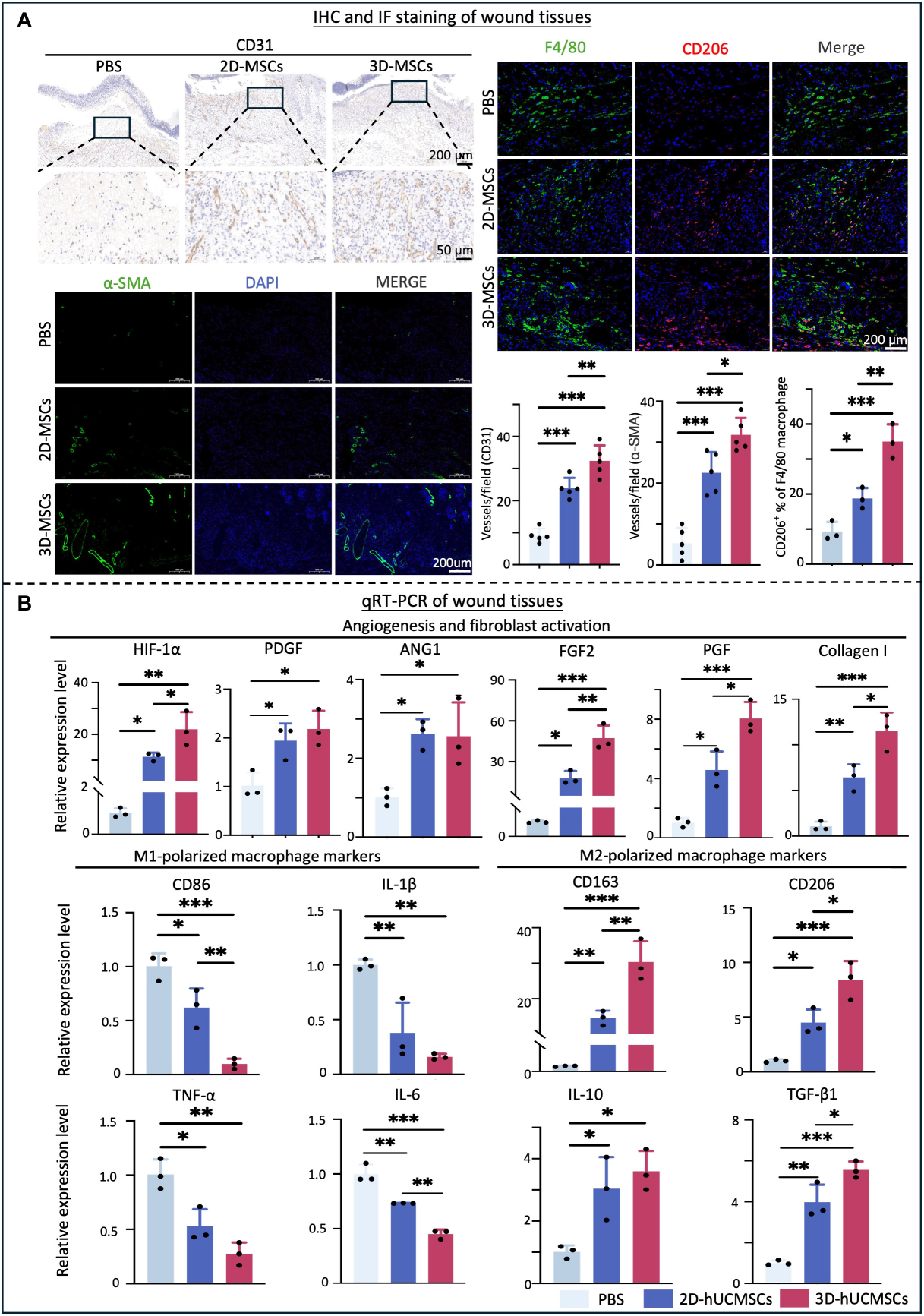
取自原文:Fig 8
组织再生模式,特别是新生血管网络的空间分布,与早期伤口愈合过程中的血管生成模式密切相关。IHC染色表明3D-hUCMSCs组血管生成相关蛋白CD 31的蛋白表达水平较高。IF染色显示3D-hUCMSCs组血管生成相关蛋白a-SMA和M2极化巨噬细胞相关蛋白CD 206的表达水平较高(Fig 8.A)。M1极化巨噬细胞的旁分泌信号是血管内皮细胞和成纤维细胞功能障碍的原因之一。qRT-PCR分析血管生成相关基因、成纤维细胞激活相关基因、M1/M2极化巨噬细胞标志物的mRNA表达水平,发现与上述染色结果一致,提示3D-hUCMSCs可能通过诱导M2型巨噬细胞极化来潜在调节炎症反应促进血管化。
研究结论
总的来说,研究展示了使用自动化和封闭的3D微载体-生物反应器系统培养的hUCMSCs的高质量性及其在糖尿病伤口修复方面的广阔潜力,为临床细胞治疗提供了一种可靠且可转化的方法。
3D智能平台研究技术支持
本项研究由干细胞三维培养制备技术由中科睿极(海宁)生物科技有限公司提供支持,包括DASEA® 生物智造平台的MSCs、DASEA® Ultramedia® Pro培养基、DASEA® Regencarrier® 仿生型微载体、PBS、裂解液、DASEA® Regenbio 全自动3D细胞培养系统(2L/5L 台式生物反应器)
原文链接:https://doi.org/10.34133/bmr.0205
最热新闻

2025-06-25

2024-08-23

2024-07-18

2024-06-22

2024-06-17

2024-05-28

2024-05-27

2024-02-05

2024-01-03

2024-06-21
相关标签






