这是国内首款获得CDE药用辅料资质、可用于细胞药物开发的非动物源性(AOF)细胞用微载体。
作者:中科睿极
浏览量:1627

2024-01-03
分享
DASEA® 重组人源胶原微载体研发传捷报,成功通过国家药品监督管理局药品审评中心(CDE)评审,成为国内首款获得CDE药用辅料资质、可用于细胞药物开发的非动物源性(AOF)细胞用微载体(登记号:F20230000567)。
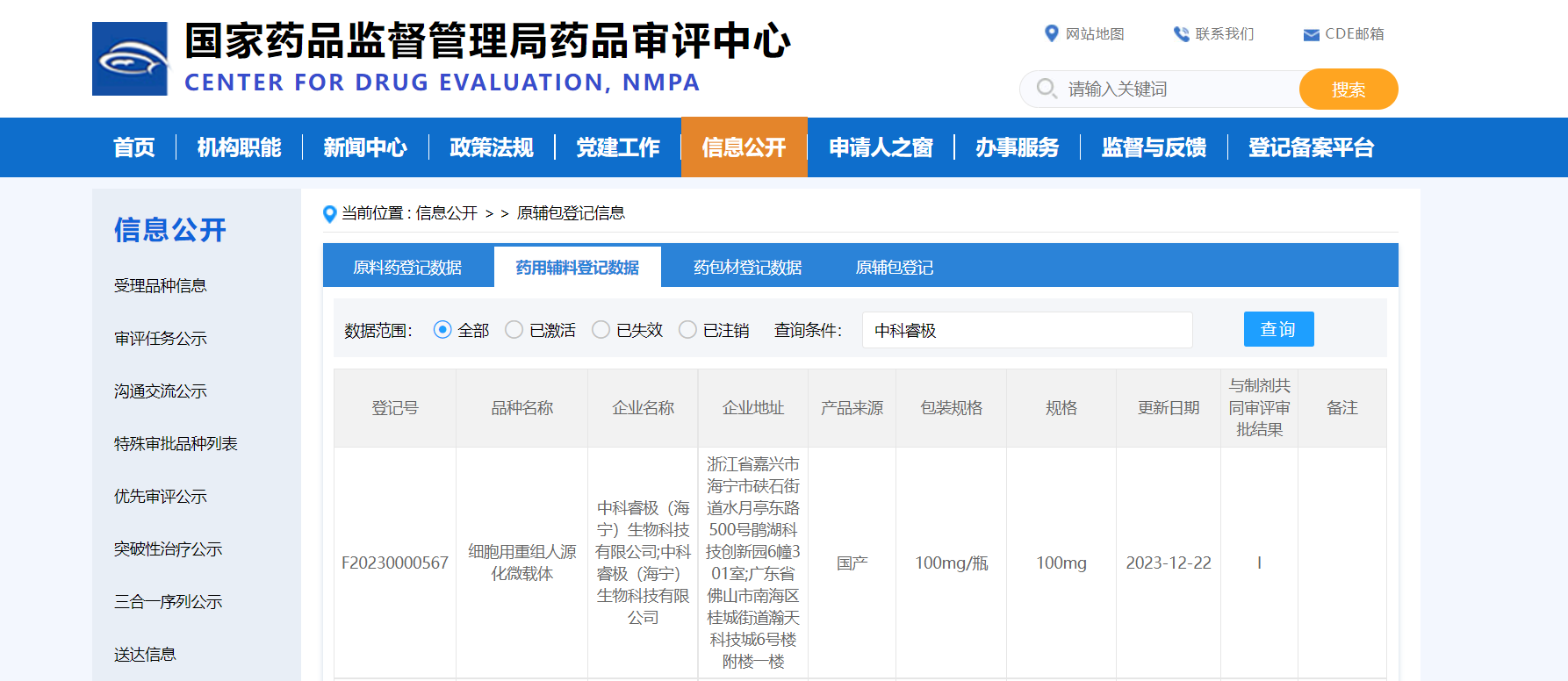
药品审评中心(CENTER FOR DRUG EVALUATION,CDE)是国家食品药品监督管理局药品注册技术审评机构,负责组织对药品注册申请进行技术审评,既是国家药品注册审评的权威机构,也是相关信息公示的官方平台。此次DASEA® 重组人源胶原微载体获得药用辅料资质备案,充分反映了CDE对DASEA® 生物智造平台产品质量和安全性的高度认可。
助力干细胞药物研发与申报
随着细胞治疗企业的蓬勃发展,我国的相关监管机构对细胞治疗产品的生产、质量稳定性和技术标准要求正在逐步提高。在细胞与基因治疗药物的IND申报过程中,原辅料的质量控制成为其中一项主要挑战。IND申报要求需尽可能使用无动物源性的生产原料,以降低引入外源病毒的风险。
DASEA® 重组人源胶原微载体无动物源材料,成功简化了细胞收获与分离等痛点,有效地解决了传统微载体细胞生长面积不足、对流体剪切力缺乏保护性、材料的生物相容性不稳定、细胞收获与分离复杂性等缺陷问题,能有效提升细胞培养效率和收益。同时,产品的核心材料已完全实现国产化,规避了传统微载体原材料来源依赖进口、来源不可控的问题,极大提高了我国产业链的自主可控性。此外DASEA® 重组人源胶原微载体可温和降解,能降低外源性成分去除工艺的复杂性,提高细胞培养的安全性,为推动细胞基因治疗产品的专业化和标准化提供关键的技术支持。
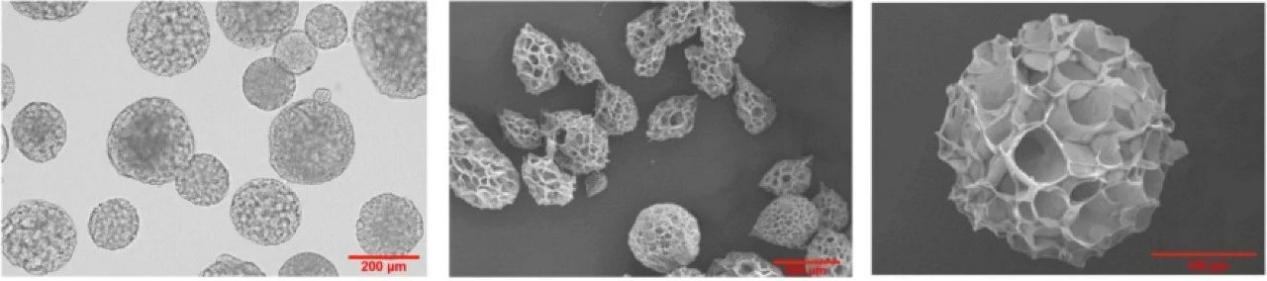
重组人源化微载体在光镜下和在扫描电镜下的形貌
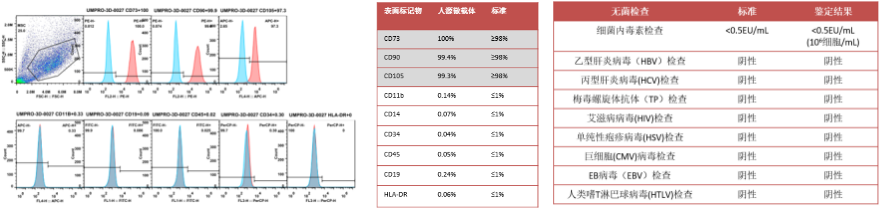
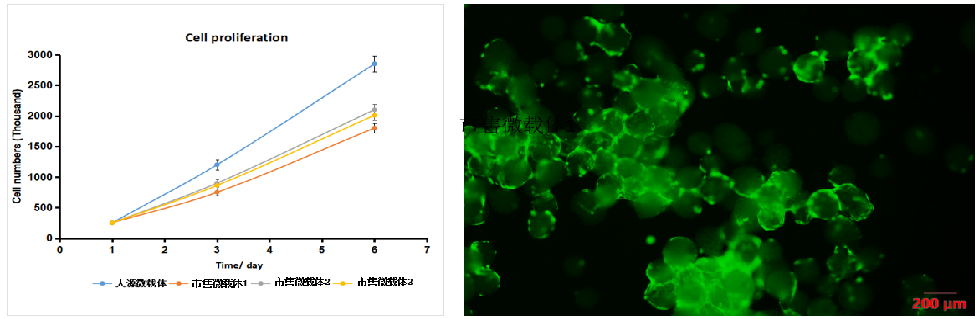
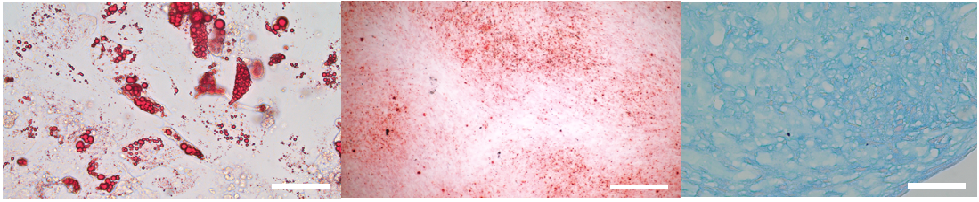
中科睿极重组人源化微载体表征:1)细胞表型测试合格;2)病毒检测合格;3)细胞增殖6天可达12倍;4)三系分化测试合格
在基因与治疗药物研发与申报中,采用获得MF资质备案、DMFⅡ型药用辅料资质备案、CDE药用辅料资质的DASEA® 重组人源胶原微载体,能够减少产品审查和评估时间,提高IND通过效率,从而加速细胞药物申报进程。

获得多项中美药监局资质全球领先
作为DASEA® 生物智造平台核心产品之一,DASEA® 重组人源胶原微载体于2023年5月全球首发,并先后成为全球首款获得美国食品药品监督管理局生物制剂评价与研究中心(CBER)颁发的MF资质备案、药品评价与研究中心(CDER)颁发的DMF Ⅱ型药用辅料资质,可用于细胞药物开发的药用辅料级非动物源性( AOF )细胞用微载体,标志着我国自主研发的重组人源胶原微载体取得了世界领先水平。
以国家科技进步一等奖获得者、国家重大人才工程特聘专家、中科睿极首席科学家张智勇教授为核心的科研团队,早在2009年开始自主研发针对干细胞的仿生型微载体,积极申请并获得了新加坡本地科研基金的支持。这也是中科睿极DASEA生物智造平台的仿生型微载体的研发起源。2011年,张智勇教授作为第一课题负责人开展“多功能型微载体的构建及组织工程骨一体化制备方法的研究”研究工作,获得国内第一个科研基金资助 (国家自然科学基金),开启了在国内研发新型的生物仿生型微载体的进程。张智勇教授也因为其包括微载体研发在内的长期再生医学转化研究工作,作为核心完成人荣获的2021年国家科技进步一等奖,受邀参加了国家科学技术奖励大会,受到国家领导人亲自接见与颁奖,这也是当时仅有的17项国家科技进步一等奖中唯一的医学类项目。
从获得国家科技进步一等奖到先后获得中美国家药监局药用辅料资质备案,这充分说明中科睿极团队不仅在科研学术创新方面获得国家认可,其科技创新、成果转化落地也得到了国内外政府权威机构的肯定。中科睿极将继续秉承“激情创新”的信念,深耕硬核科技技术,为细胞治疗产品的质量和稳定性护航,满足临床转化和应用需求,赋能基因与细胞治疗药物研发,助力细胞与基因治疗产业的高质量发展,为“让再生医学成为临床治疗的常规选项”持续突破!
最热新闻

2025-06-25

2024-08-23

2024-07-18

2024-06-22

2024-06-17

2024-05-28

2024-05-27

2024-02-05

2024-01-03

2024-06-21
相关标签






