与您分享首席论道,期望早日实现ATMP科学监管
作者:中科睿极
浏览量:426

2024-06-22
分享
以再生医学为代表的细胞基因治疗(CGT)是人类的第三代药物,是中国医药创新弯道超车的历史性机遇,目前国内已有多款产品相继上市。我国针对CGT的监管进入规范发展阶段,加强了CGT及生物安全等领域的技术指导和法律法规制定。中科睿极作为CGT产业化制备的一站式解决方案供应商,非常关注政策法规动向与调整。
国家药监局评审中心近日于《中国食品药品监管》杂志上发表新文章,探讨我国先进治疗药品的范围及分类研究,并提出将CGT药物纳入先进治疗药品(ATMP)范畴的建议。

图片来源:中国食品药品监管杂志
专注于再生医学临床转化研究近二十年,中科睿极首席科学家张智勇教授是国家食药总局三类医疗器械产品注册技术评审专家,受邀参与国家药监局干细胞外泌体规模化制备和质量标准研究等监管科学研究,并参与起草了《人源间充质干细胞外泌体》团体标准(标准号:T/FDSA0049-2024),一直以来非常关注我国及全球CGT药物的监管政策,对于国家药监局的提议,张智勇教授提出了自己的见解。

张智勇教授起草《人源间充质干细胞外泌体》团体标准的荣誉证书
首席论道 · 中科睿极首席科学家张智勇教授
ATMP监管科学的巨大思路转变
这是一个对于行业巨大利好的政策,CGT药物按ATMP监管,设立ATMP新的分类界定,这代表着中国国家药品监督管理局(NMPA)对于CGT药物科学监管的思路巨大转变,势必加速整个行业高速发展。
政策研究背景
近年来,以细胞和基因治疗产品为代表的ATMP,为癌症、遗传病、罕见病等疑难疾病的治疗带来了新的契机和选择。ATMP通常采用细胞或组织经基因修饰和(或)体外操作制备,种类包括基因修饰细胞、核酸、病毒载体和人工组织等,为复杂的医疗挑战提供了新的解决方案。由于这类产品类型复杂、多样,明确其定义和监管分类,有利于优化产品注册申报路径,加速各类产品技术指南的发布,推动产品快速研发上市,助力我国药品监管与国际接轨。
首席论道 · 中科睿极首席科学家张智勇教授
复杂/复方产品解决复杂问题
对于复杂的CGT药物,不可用传统单一靶点的化药、抗体药的申报思路去理解。如果像传统药物一样片面地追求单一靶点、组分的清晰度,这样就失去了ATMP对复杂疾病治疗的优势,并且会导致此类药物上市周期很长。传统药物开发的专利断崖和前几年低谷就是单一靶点的单因素疾病的低垂果实被摘完,剩下来的不管肿瘤还是衰老都是超多靶点的复杂因素疾病,只有用细胞作为载体的多治疗因子/复方才能解决这些复杂疾病问题,例如,HIV的鸡尾酒疗法,复杂产品的监管思路要不一样,要有系统论的思维。而设立ATMP新的分类界定就是NMPA针对这类全新的药物/疗法监管思路的巨大转化,将推动整个行业高速发展。
全球ATMP的监管现状
全球诸多国家和地区不断致力于强化ATMP的监管体系顶层设计和监管能力建设。美国食品药品监督管理局(FDA)、欧洲药品管理局(EMA)、日本药品医疗器械综合机构(PMDA)等药品监管机构逐步建立了ATMP的监管框架,积极制定发布相关法规及指南,并不断完善。
据不完全统计,全球各监管机构迄今已发布400余个细胞与基因治疗产品相关的技术指南。部分国家和地区在法律法规层面明确了这类药品的定义及分类,并制定激励政策(如特殊审评程序等)加速产品审批上市。
美国、欧盟和日本等国家和地区对先进疗法均存在药品监管和医疗技术监管两条路径,其中日本、中国涉及两个机构分别负责药品和医疗技术的监管。FDA、EMA、PMDA等药品监管机构在法律法规层面均明确了该类产品的定义和分类,并为该类产品专门设置了专业审评办公室。世界卫生组织(WHO)于2023年发布了ATMP的定义和分类相关的技术指南。为加速具有临床价值的产品快速审批上市,FDA、PMDA均对该类药品出台了加速审评程序,EMA为该类产品审评审批成立了专门的先进治疗委员会(CAT),并特别设置了ATMP分类程序。
首席论道 · 中科睿极首席科学家张智勇教授
欧美的ATMP政策趋于完善
美国FDA和欧洲EMA对ATMP的监管起步比较早,他们十几年前就设立了ATMP的分类界定,一开始是针对了组织工程、干细胞等带细胞类的复杂医疗技术/产品,当年分类两个核心核心在于:
1)是否minimally invasive(美国是<48小时,欧盟是<72小时,导致很多产品先到欧盟做);
2)自体vs异体等,随着技术的发展及思路的转变,政策也逐步趋于完善,值得借鉴与学习。
我国ATMP监管现状及国内外监管对比
目前,我国对于细胞治疗产品采用双轨制进行管理,包括药品路径向NMPA申报,按照生物制品审评审批上市,或由国家卫生健康委员会对医疗技术施行备案管理。
技术指南方面,NMPA已制定发布的ATMP技术指南30余个,其他可以适用的通用型指南约100余个,覆盖药学、非临床和临床研究领域,产品类型包括免疫细胞治疗、体内基因治疗、基因修饰细胞、人源干细胞、溶瘤病毒等。但目前尚未在法律法规层面明确该类药品的分类与定义,其名称和分类尚未形成行业共识,名称使用及分类的不统一,不利于规范监管、行业沟通及国际协调。
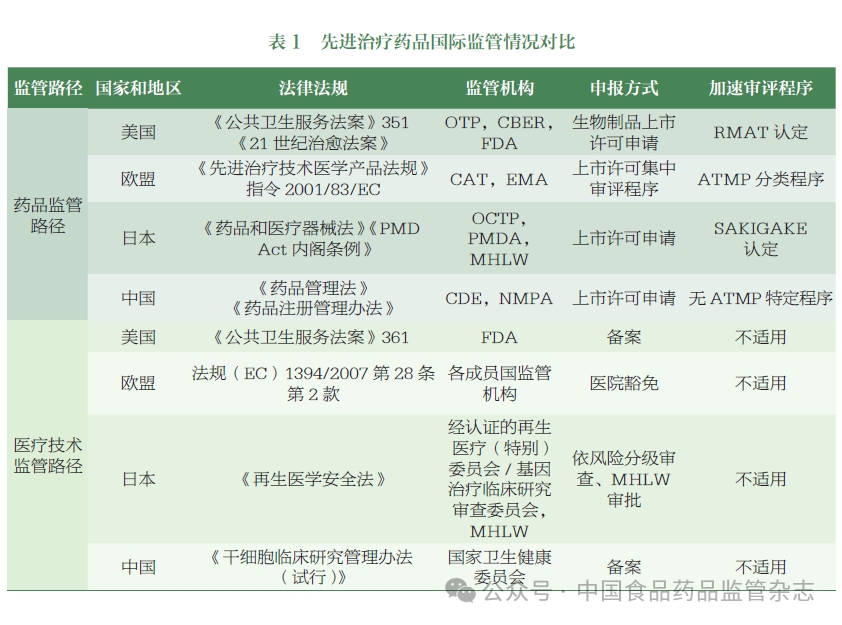
图:各国家和地区均存在药品监管和医疗技术监管两条路径。(图片来源:中国食品药品监管杂志)
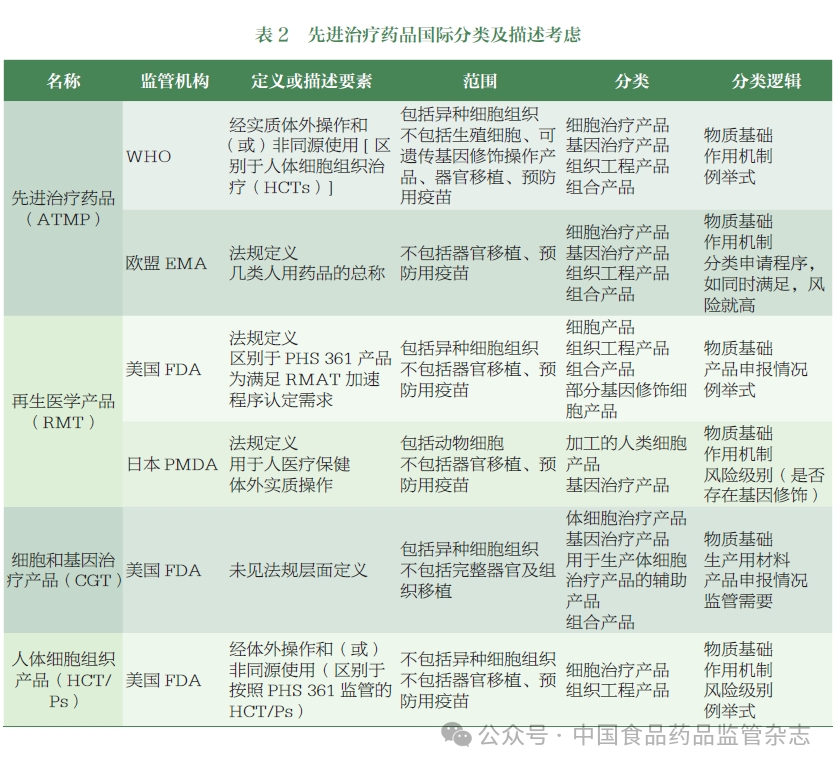
注:各监管机构基于不同的物质基础、作用机制以及监管需要等因素,对ATMP进行了分类。(图片来源:中国食品药品监管杂志)
国际先进监管机构在法律法规层面明确了ATMP的定义及分类,并在科学层面结合产品的物质基础、体外操作特点、功能用途等方面,采用描述、例举等方式明确了各类产品的释义,为该类产品审评技术标准体系建设和加速审批制度建立奠定了良好监管基础。
现阶段我国尚未在药品监管法规层面明确其范围和分类,也未针对该类产品设置特殊认定程序和与之相应的加速审评审批机制。针对这类产品制定明确的分类与界定,有利于制定相应的技术要求服务于产品的研究与开发,同时,也有利于制定相关的监管政策与鼓励措施以促进产业的发展。
首席论道 · 中科睿极首席科学家张智勇教授
我国ATMP监管待与国际接轨
随着细胞和基因治疗类产品申请数量的逐年增多,我国对这类药物申报的管理需要进一步完善。这一类新兴产品由于其生产及质量控制的复杂性、特殊性,个性化程度高,例如自体CAR-T类产品为个性化治疗产品,具有批量受限,同时供者材料来源于人体、产品为活细胞,其生产、保存、运输、回输过程复杂等特点,原本的药品生产质量管理规范(GMP)及相关指南已经无法适应新兴产品生产的需要,鉴于欧美地区已有较为完善的监管体系,我们可以建立一套与国际统一的检查标准,促进全球监管趋同。
我国ATMP分类和描述的建议
名称与描述:建议采用“先进治疗药品”作为ATMP的中文名称,英文名称为“ATMP”。描述方面,应涵盖物质基础、工艺特点、功能用途等要素,同时基于体外操作程度和使用情形等对医疗技术相关边界产品的分类进行界定。即描述为:“先进治疗药品是指经体外操作生产并在体内发挥作用的细胞治疗药品、基因治疗药品或组织工程药品,以及采用其他先进技术/方法生产的创新型药品等。”
物质基础方面,可考虑纳入目前国内申报量较大的产品类型如细胞治疗产品、基因治疗产品,同时纳入组织工程产品和其他新兴技术产品,为新技术预留接口。
工艺特点方面,结合FDA、EMA、WHO等相关定义,通过体外简单操作制备且同源使用的细胞组织治疗产品不属于ATMP。因此笔者参考国际监管实践,结合产品生产常见工艺步骤,对描述中的“体外操作”明确了简单的释义,主要包括分离、纯化、扩增、基因修饰、基因编辑等。后续如有需要,将参考FDA和其他监管机构的做法,进一步明确“体外操作”“同源使用”等定义。
功能用途方面,参考国内生物制品监管现状,考虑到目前申报的产品主要为治疗用生物制品,因此描述中仅明确为治疗药品,暂不涉及预防、诊断相关用途。
分类建议:将ATMP分为细胞治疗药品、基因治疗药品和其他类。其中,细胞治疗药品可进一步细分为非基因修饰细胞治疗药品和基因修饰细胞治疗药品;基因治疗药品的描述和亚类划分可参照国际监管机构的相关标准;其他类则包括一些创新性强、研发成熟度相对较低的产品,例如肿瘤新生抗原产品、细胞衍生物(如外泌体)等。
首席论道 · 中科睿极首席科学家张智勇教授
ATMP监管道阻且长,行则将至
将CGT药物纳入ATMP的监管系统显然具有非常重要的意义,不仅可以规范当前CGT药物申报的标准,还可以开通加速审评流程,为加速具有临床价值的产品快速审批上市。当然,ATMP的发展也会面临一些挑战,其精确稳定制备比传统化药抗体药也更难,生物制造的工艺要求也更高。中科睿极钻研于细胞治疗上游工艺的研究,首席科学家张智勇教授从2006年起研发反应器,2009年起研发微载体,一直致力于研究干细胞的三维规模化、自动化培养技术,基于19年丰富的干细胞与再生医学临床转化研究成果,为中科睿极DASEA 生物智造平台奠定了扎实基础。
DASEA 生物智造平台,旨在实现细胞、外泌体等生物制品制备的数字化(Digitalized)、自动化(Automated)、规模化(Scalable)、封闭化(Enclosed)、活性化(Activated),是中国生物制品制备“5化”目标的首提者和积极倡导者。
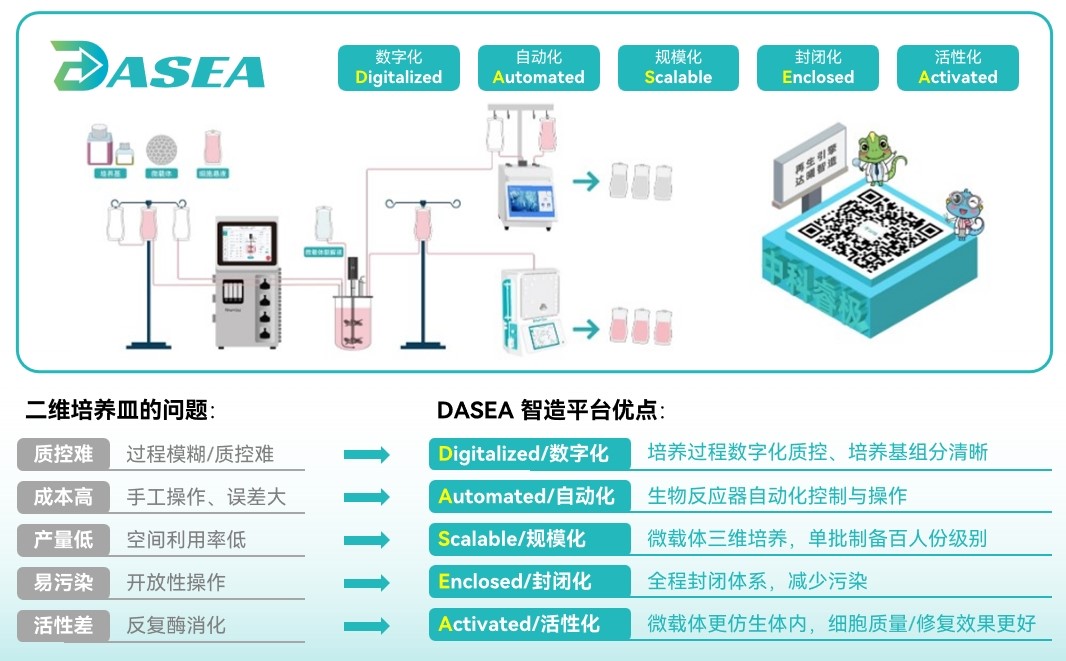
中科睿极在细胞培养领域积累了丰富的经验,技术方面已取得了57项自主知识产权,可助力研发企业/机构加速CGT药物的研究进程。随着我国ATMP分类与定义的提出,将有望进一步提升ATMP的监管效能,中科睿极也将紧随政策的完善而及时调整相关法规要求,为细胞相关研发企业/机构提供值得信赖、高效专业的一站式解决方案,让再生医学成为临床治疗的常规选项。
参考:
卢加琪,刘丹,寇雅真,王雪,陈昊,王文波,尹华静,王晶,孙涛,韦薇,鲁爽,王庆利,何伍,王涛*.我国先进治疗药品的范围及分类研究和建议[J].中国食品药品监管,2024(5):10-26.
最热新闻

2025-06-25

2024-08-23

2024-07-18

2024-06-22

2024-06-17

2024-05-28

2024-05-27

2024-02-05

2024-01-03

2024-06-21
相关标签






